|
Parte quarta
Stabilità instabilità
atmosferica
Introduzione alla termodinamica
1) Motori termici
|
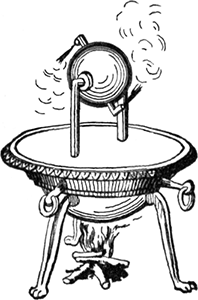
Fig. 1 - L’eolipila di Erone
|
|
|
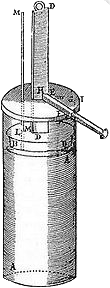
Fig. 2 - Il cilindro con pistone di Papin
(1790)
|
|
Erone fisico e matematico greco di
Alessandria (primi secoli AD) fu il primo a costruire una
macchina, l’eolipila, che trasformasse l’energia termica in
lavoro. Questa era una sfera riempita d’acqua con due
beccucci diretti e posti in direzioni diametralmente opposte
e poggiante su due sostegni mediante dei perni. Riscaldando
la sfera, l’acqua produceva vapore in pressione che fuggiva
dai due beccucci mettendola, per reazione, in rotazione. Fu
solo un esperimento, accolto come una curiosità, che non
ebbe alcun seguito per più di 15 secoli.
Nel 1682 il fisico e medico francese
Denis Papin presenta alla Royial Society di Londra il
"digestore", la prima pentola a pressione della storia con
la relativa valvola di sicurezza.
Nel 1690 lo stesso Papin pubblica a
Lipsia, nella collana "Acta Erutitorum" , un articolo in cui
presenta un esperimento realizzato con sistema
cilindro-pistone , Fig. 2.
Una certa quantità d’acqua è fatta
evaporare nel cilindro scaldandolo opportunamente con il
pistone tenuto in alto. Il vapore sostituisce l’aria. Il
cilindro viene poi raffreddato; il vapore si condensa e si
crea così un certo grado di vuoto. Sulla superficie
superiore del pistone liberato di discendere, verrà ad agire
solo la pressione atmosferica (ca 1 Kg /cm2), producendo una
forza che può essere sfruttata. Basandosi su questi studi ed
esperimenti, l’ingegnere militare inglese Thomas Savery
sviluppa nel 1698 il primo motore a vapore della storia per
pompare acqua dalle miniere. Esso non ha parti in movimento.
Utilizza il vuoto (relativo) che si può creare in un
contenitore di vapore con un raffreddamento che ne determini
la condensazione per aspirare l’acqua con la spinta della
pressione atmosferica (altezza max di aspirazione < di 10
m).
Successivamente l’ingegnere inglese
Thomas Newcomen sulla base delle esperienze di Papin e delle
realizzazioni di Savery costruisce la prima macchina a
vapore in grado di produrre movimento meccanico mediante il
movimento di un pistone che attaccato ad una trave
oscillante azionava una pompa per estrarre l’acqua (Fig.
3).
La forza motrice era ancora la pressione atmosferica che si
esercitava sul pistone del "cilindro di Papin". Il motore di
Newcomen molto più efficace (per il suo scopo) del motore di
Savery si diffonde rapidamente in tutta l’Inghilterra , in
Europa e dopo il 1755, anche in America.
|
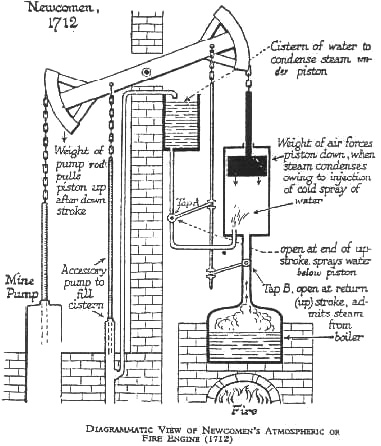
Fig. 7 - La macchina di Newcomen. 1712
|
|
Ma la vera svolta che dette via alla così
detta rivoluzione industriale si ebbe con il giovane
ingegnere di Glasgow James Watt il quale riparando un motore
Newcomen ebbe l’idea di aggiungervi una camera di
condensazione dove far giungere il vapore. Con ciò veniva
aumentata notevolmente l’efficienza e si poteva operare a
ciclo continuo anche se la forza motrice e massima nel ciclo
rimaneva ancora la pressione atmosferica .
Watt risolse in seguito anche il problema
di trasformare il movimento rettilineo del pistone in
movimento rotatorio, introdusse la cassetta di distribuzione
del vapore ed il regolatore centrifugo. Il primo esemplare
di motore commerciale fu realizzato nel 1776 . In suo onore
è chiamata Watt, W, l’unità di potenza.
|
2. La termodinamica
Le macchine a vapore successivamente
ulteriormente perfezionate si diffondevano in tutto il
mondo, si entrava nell’era industriale ma ancora non era
stata definita una teoria razionale del calore, ancora non
era nata la termodinamica. In particolare quale era il ciclo
termodinamico ad esempio pressione - volume ottimale , quale
era il rendimento massimo ottenibile da un motore termico?
|
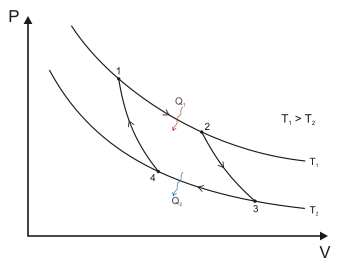
Fig. 8 - Ciclo di Carnot nelle variabili Volume -
Pressione
|
|
A queste domande tentò di dare una
risposta il giovane ingegnere e fisico francese Sadi Carnot
nel suo saggio: "Réflextions sur la puissance motrice du feu",
"Riflessioni sulla potenza motrice del fuoco" pubblicato a
Parigi nel 1824 . Ancora pur basandosi sul concetto errato
del calore, il "calorico" , come fluido immateriale,
indistruttibile , che poteva passare da un corpo all’altro,
fece delle riflessioni fondamentali sui motori termici che
saranno le basi per lo sviluppo di una nuova branca della
fisica, la termodinamica.
1) Un motore termico deve operare tra due
sorgenti a temperatura diversa.
2) Il rendimento inteso come lavoro
prodotto, rapportato al consumo di energia
per produrlo,
dipende dalle temperature delle sorgenti ed è maggiore se la
loro differenza è maggiore.
3) Il rendimento è indipendente dal
fluido che è usato nel motore.
Indicò ancora un ciclo termodinamico, il
ciclo detto in seguito "di Carnot" composto di due
trasformazioni isoterme (a temperatura T1 e T2 costanti)
chiuse da due adiabatiche (senza scambio di calore con
l’esterno). In tal modo il "calorico "non sarebbe disperso
(non essendoci gradienti di temperatura in gioco durante le
isoterme) e l’energia prodotta W sarebbe dovuta al flusso
del "calorico" stesso attraverso il salto termico t1-t2
analogamente di quanto avviene in una macchina idraulica
(mulino) dove a parità di portata il lavoro prodotto
nell’unità di tempo è dovuto al salto dell’acqua. Tale ciclo
sarebbe completamente reversibile cioè il motore potrebbe
simmetricamente funzionare all’inverso pompando calore (o
calorico) dalla sorgente fredda a quella calda consumando lo
stesso lavoro W.
Stabilì ancora che nessun motore termico
operante tra quelle due temperature potrebbe avere un
rendimento maggiore di quello caratterizzato dal ciclo di
Carnot.
Questa affermazione è, in nuce,
espressione della seconda legge della termodinamica.
|

Fig. 9 - Nicolas Leonard Sadi Carnot: Parigi
1796, Parigi 1832.
Ingegnere, fisico, anticipatore della termodunamica
|
|
La dimostrazione si basa sulla
reversibilità della macchina di Carnot. Accoppiamo infatti a
questa, funzionante da pompa tra due serbatoi rispettivamente
tra le
temperature T1 e T2, con flusso di calore Q1 e lavoro
richiesto W1 una macchina termica operante tra gli stessi
serbatoi con eguale flusso di calore ma rendimento maggiore
(cioè producente più lavoro di quello richiesto dalla pompa,
in valore assoluto W2 > W1 a parità di flusso di calore (o
calorico) transitante. La differenza W2-W1 positiva, sarebbe
data senza alcun consumo di calore nei serbatoi realizzando
così un moto perpetuo producendo lavoro netto, impossibile
come ipotesi.
Il saggio di Carnot presentato a l’Academie
de France nello stesso anno non suscitò particolare
interesse nella comunità scientifica internazionale.
Solo parecchi anni dopo, verso il 1860,
quando, grazie anche all’esperimento di Joule, ormai il
concetto di calorico stava per essere abbandonato, il grande
fisico tedesco Rudolf Clausius, riflettendo sul saggio di
Carnot potè presentare nuove fondamentali determinazioni
relative alla fisica del calore, del lavoro e dell’energia .
Il calore è una forma di energia che
trasferendosi su un sistema fisico assieme al lavoro
eventualmente esercitato su di esso ne determina l’aumento
di energia interna dU
del sistema. U
è una grandezza del sistema, determinata univocamente a meno
di una costante, dei parametri fisici , come moli, pressione
e volume e temperatura . E’ la prima legge della
termodinamica:
|
|
1)
dU = dQ – dL che
diventa :
2)
dU = dQ – PdV se il lavoro è esercitato dalla
pressione di un gas P
per una variazione di volume
dV
- Non si può creare ne distruggere
l’energia ma solo trasformarla.
Esiste una "freccia del tempo", la
materia tende spontaneamente all’uniformità,
all’appiattimento.
Due corpi uno più caldo dell’altro messi
a contatto tenderanno inevitabilmente ad assumere la stessa
temperatura ed il calore passerà dal più caldo al più
freddo, da cui:
E’ impossibile che il calore passi,
senza utilizzare lavoro od altra energia esterna, da un
corpo a temperatura più bassa ad uno a temperatura più alta.
E’ il principio base di Clausius della
seconda legge della termodinamica.
Direttamente derivabile da questa e già
individuata da Carnot è il principio di del grande fisico
inglese Lord Kelvin:
Non si può ottenere del lavoro a partire
da una sola fonte di calore di una temperatura determinata.
|
|

Fig. 10 - Rudolf Clausius, Köslin (Prussia) 1822,
Bonn Germania 1888. Grande fisico tedesco.A lui si
deve la formulazione della prima e seconda legge
della termo-dinamica
|
|
|

Fig .11 - Ludwig Boltzmann: Vienna ,1844 Duino
(Trieste), 1906.
Grande fisico Teorico e matematico austriaco
|
|
Carnot presentando il suo ciclo ideale
tra due sorgenti con il fondamentale attributo di
reversibilità cioè della proprietà di poter essere percorso
al contrario senza lascia traccia sull’ambiente esterno,
pensava che il "calorico" passasse, senza perdite, dalla
sorgente a temperatura maggiore a quella a temperatura
inferiore, producendo lavoro. Caduto il concetto di
"calorico" ed introdotto quello di calore che può essere
prodotto o perso, Clausius analizzando il ciclo di Carnot
verificò che ciò che non andava perso durante la
trasformazione non era il "calorico" ma la quantità di
calore Q divisa
per la temperatura assoluta
T (definita da
Kelvin) , quantità che in seguito chiamerà entropia =
S.
Si ha cioè che se
Q1 è
la quantità di calore ricevuta dalla sorgente a temperatura
T1 e
Q2 è
la quantità di calore rilasciata alla sorgente a temperatura
T2
3)
Q1 / T1
= Q2/T2 .
Inoltre, in tutte le trasformazioni
cicliche si ha, utilizzando la simbologia matematica
dell’integrale ciclico indicando con
dQ quantità i
finitesime di calore, positiva se assorbita dal sistema, la
diseguaglianza detta di Clausius :
4)
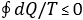
|
L’uguaglianza valendo solo per i cicli
completamente reversibili. Si ha cioè, nelle situazioni
reali una produzione netta della quantità
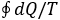 all’esterno del sistema che subisce il ciclo, ciò che
consente al sistema stesso di ritornare al punto di partenza
. Il segno = nell’integrale ciclico inoltre, consente di
definire una funzione di stato (cioè dipendente solo dai
parametri del sistema quali ad es. per un gas
P,V ; P,To P,T)
la cui variazione infinitesima è
dS = dQr/T.
all’esterno del sistema che subisce il ciclo, ciò che
consente al sistema stesso di ritornare al punto di partenza
. Il segno = nell’integrale ciclico inoltre, consente di
definire una funzione di stato (cioè dipendente solo dai
parametri del sistema quali ad es. per un gas
P,V ; P,To P,T)
la cui variazione infinitesima è
dS = dQr/T.
Sia dato un sistema termodinamico che
subisca un ciclo C
di trasformazioni. Un tratto del percorso definito dai due
estremi A e
B sia
irreversibile mentre il rimanente, da
B ad
A sia
reversibile. Nel complesso, il ciclo è irreversibile. La
disuguaglianza di Clausius porge:
4')
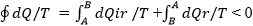
Se il percorso
AB fosse anch’esso
reversibile si avrebbe:
4")
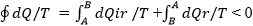
E ponendo =
dS = differenziale dell’entropia
S si deduce
facendo tendere la lunghezza del cammino
AB a
0 che per
tutte le trasformazioni reali cioè irreversibili:
5)
dS ≥ dQ/T
Se il sistema in cui avviene il ciclo è
isolato dQ = 0 e dS ≥
0
Nelle trasformazioni cicliche
irreversibili il sistema per tornare allo stato iniziale
caratterizzato dalla stessa entropia deve rilasciare
entropia nell’ambiente secondo la 5) di modo che si avrà
sempre
6)
dSt= dS sist + dSamb ≥ 0
Con l’introduzione della funzione
entropia S la
prima legge della termodinamica
7)
dU = dQ - dL
scritta in forma differenziale diventa:
8)
dU = TdS – dL
E per le trasformazioni reversibili dei
gas:
9)
dU = TdS – PdV
3. L’entropia dal
punto di vista statisico
In ogni processo fisico (sempre
irreversibile) si ha un aumento totale di entropia del
complesso del sistema in cui il processo avviene e
dell’ambiente esterno. Nel mondo fisico, nell’intero
universo, l’entropia aumenta. E’ una tendenza ineliminabile
verso il disordine, o piuttosto verso l’uniformità, verso
l’appiattimento.
Il grande fisico e matematico austriaco
Louis Boltzman riuscì a collegare l’entropia
S con le
configurazioni fisiche che determinano uno stato
termodinamico con la famosa relazione per una mole di
sostanza:
10) S = K ln W
Con
W numero dei microstati (stati fisici delle
particelle del gas) che determinano il macrostato (espresso
dai parametri termodinamici),
K = R/NA dove
R= costante dei
gas perfetti , NA
= numero di Avogadro
Si ha così:
11) S = 1,38 10-23 ln W J/K
|