|
Parte prima
Stabilità instabilità atmosferica
Le piogge sono generate dalla
condensazione del vapore d’acqua attorno a dei nuclei di
condensazione (germi di condensazione) quando l’aria
raffreddandosi diventa satura.
1) Composizione
dell’atmosfera terrestre
L’aria dell’atmosfera terrestre in
prossimità del suolo ha la seguente composizione molare od
in volume:
| N2 Azoto (peso molecolare 28) |
78% |
| O2 Ossigeno (peso molecolare 32) |
21% |
| Ar Argon (peso molecolare 40) |
0,93% |
| CO2 Anidride carbonica (peso
molecolare 44) |
0,04% |
| H2O Acqua (peso molecolare 18) |
0,001% - 5% |
Il peso molare dell’aria corrisponde a
circa 29 g /mole.
La mole (atomica o molecolare) contiene
un numero di particelle (atomi o molecole) paria al numero NA
di Avogadro = 6,022 1023 circa . Il peso o massa
di una particella, atomo o molecola, è espresso in unità di
massa atomica. L’unità di massa atomica ( secondo il Sistema
Internazionale di Misura) corrisponde esattamente ad 1/12
della massa dell’atomo di carbonio 12C composto
da 6 protoni e 6 neutroni.
2) l’aria
atmosferica come gas perfetto
L’invenzione del barometro a mercurio da
parte di Torricelli nel 1643 e di termometri affidabili
(Scuola del Cimento Firenze 1630) dette inizio alla sviluppo
di quella branca fondamentale della fisica che è la
termodinamica che si può definire come: studio del calore e
della temperatura e delle loro relazioni con l’energia, il
lavoro e parametri fisici come volume e pressione in
particolare per i gas
2.1 Legge dei gas perfetti
Nel 1661 il fisico inglese R. Boyle
pubblicò la prima legge sui gas:
La pressione di una determinata
quantità di gas che compie una trasformazione a temperatura
costante è inversamente proporzionale al volume occupato:
1) PV= K
Dove P = pressione, V = volume, K
costante funzione della quantità (peso) e del tipo di gas
Tale legge fu formulata qualche anno dopo
anche dal fisico francese E. Mariotte per cui prende anche
il nome di legge di Boyle – Mariotte.
Essa è valida con buona approssimazione in un “range”
determinato di temperatura e pressione che comprende i
valori usuali dell’atmosfera terrestre
|

Fig.1 - L’ascensione in una mongolfiera ad idrogeno di Gay Lussac e Jean Baptiste Biot
1804.
Illustrazione
della fine del
19° secolo
Fonte: Wikipedia
|
|
Nel 1802 il grande fisico e chimico
francese Gay Lussac, famoso anche per la leggendaria
ascensione in mongolfiera sino a ca. 7000 m di quota nel
1804 per studiare l’atmosfera, formulò anche la sua prima
legge sul comportamento dei gas (detta anche prima legge di
Charles che la propose ma non la pubblicò nel 1787 come fece
pure Alessandro Volta nel 1791):
A pressione costante una determinata
quantità di gas occupa un volume funzione lineare della
temperatura
Cioè, se ad es. Vo è il volume a 0 gradi
°C , abbiamo alla temperatura centigrada t
2) V = V0 (1 +
αt)
Con
α = 1/273,2 ca
Di modo che si ha
3) V=V0(273,15+t)/273,15
E ponendo t+273,15 = T (temperatura
assoluta in gradi Kelvin), si ha:
V/V0 = T/T0
cioè :
4) V= V0
α T
con α =
1/273,15
Dove T0 è la temperatura in
gradi Kelvin corrispondenti a 0 gradi Celsius.
Il volume è proporzionale alla
temperatura assoluta (a parità di pressione)
Analogalmente formulò la “seconda legge
di Gay Lussac”
A parità di volume
la pressione è funzione lineare della
temperatura.
4) P = P0 (1 + βt)
Con β =
α = 1/273,15
5) P = P0(273,2+t)/273,15
Dove P0 è la pressione alla
temperatura t = 0 °C
Ed esprimendo ancora la temperatura in
gradi Kelvin
6) P = P0T/273,15 = P0
αT , α =
1/273,15
Da cui anche:
P/P0 = T/T0
|

Fig.2 - Amedeo Avogadro (1776-1856)
|
|
Si evidenzia come per t = -273,15 °C
corrispondenti a T = 0 teoricamente la pressione od il
volume del gas si annullino. Siamo di fronte al così detto
zero assoluto invalicabile per la materia.
Allo stesso Gay Lussac è attribuita la
legge della combinazione dei gas a temperatura e pressione
costanti che avviene in rapporti volumetrici espressi da
numeri piccoli ed interi, legge di importanza capitale per
la concezione atomistica della materia. Ad esempio due
volumi di idrogeno si combinano con un volume di ossigeno
per dare 2 volumi di acqua. Con la formula chimica:
2 H2 + 1 O2 = 2
H2O
Nel 1811 il grande fisico e chimico
italiano Amedeo Avogadro ipotizzò la seguente fondamentale
legge provata sperimentalmente qualche tempo dopo:
Nelle medesime condizioni di
temperatura e pressione, volumi uguali di gas diversi
contengono lo stesso numero di particelle. Reciprocamente un
determinato numero di particelle ad una prefissata
temperatura e pressione, occupa lo stesso volume.
Nello stesso tempo avanzò l’ipotesi che
la materia fosse costituita non solo da atomi singoli ma
anche da composizioni di atomi uguali o diversi: le
molecole.
In suo onore fu dato il nome di Avogadro
al numero di particelle (atomi o molecole) NA contenute in
una mole di materia.
Secondo il sistema internazionale ( SI)
una mole di carbonio 12C corrispondente
esattamente a 12 g , contiene NA= 6,022 1023
atomi , ed una mole di sostanza qualsiasi espressa in grammi
rappresenta il suo peso atomico o molecolare.
Riprendiamo ora la 5) e consideriamo una
mole di gas (contenente un numero di particelle = NA)
e moltiplichiamo entrambi i membri per V0 , cioè
per il volume del gas alla temperatura t = 0 °C
Abbiamo:
7) P V0 = P0 V0
αT
Con P0V0
α , grazie alla
legge di Avogadro, costante uguale per tutti i tipi di gas e
normalmente indicata con R
7’) P V0 = R T
Facciamo ora variare il volume della mole
di gas mantenendo costante solo la temperatura. Per la legge
di Boyle il prodotto non varierà pur variando i fattori ed
avremo ( indicando ancora, per comodità, con P la nuova
pressione):
8) P V= R T
Per n moli si avrà:
9) P V= n R T
|
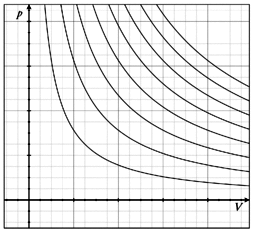
Fig.3 - Isoterme nel piano di Clayperon pV
(gas perfetti)
|
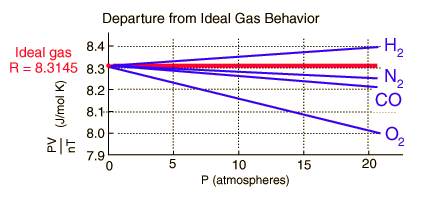
Fig.4 - Deviazione del rapporto PV/nT per alcuni gas
reali
(Wikipedia) |
|
E’ la famosa equazione di stato dei gas
perfetti od ideali presenta per la prima volta da Clayperion
nel 1843.
In un piano P,V (piano di Clayperon) essa
rappresenta al variare di T un insieme di curve iperboliche.
I gas perfetti sono modelli
termodinamici in cui principalmente si trascurano le
iterazioni attrattive delle particelle ed il volume proprio
da esse occupato e non si prevedono cambiamenti di fase.
Tali modelli sono accettabili in condizioni di bassa
pressione e moderata- alta temperatura come quelle ordinarie
dell’aria trattate in campo meteorologico.
Il valore di R nel sistema internazionale
( MKS) con P espresso in Pascal, V in m3, T in
gradi K risulta circa:
R = 8,31 J /K (Joule/ Kelvin)
Nel vecchio sistema tecnico: atmosfera ,
litri, gradi K si usava ricordare che a 0 °C ed ad una
atmosfera una mole di gas occupa ca. 22,4 litri di volume.
Le relazioni 8) e 9) stabiliscono un
legame funzionale tra le tre grandezze P, V, T esprimibile
come f(P,V,T) = 0 , per cui bastano due di queste grandezze
per definire lo stato termodinamico di un di una determinata
quantità (numero di moli n) di gas

Fig. 5 - Curve
di V an der Waals per l’anidride carbonica CO2.
I tratti punteggiati sono quelli previsti
dalla formula in cui si ha, nella realtà fisica,
la trasformazione di fase ( gas-liquido), a
pressione costante. Tc è la
temperatura del punto critico al di sopra della
quale non si può avere liquefazione del gas. I
tratti tratteggiati corrispondono alla fase
liquida.(P in KPa, V in litri) |

Fig. 6 - J. D. Van der Waals (1837 -1923)
premio Nobel per la fisica nel 1910
Fonte: Wikipedia |
2.2 I gas reali
I gas reali si comportano in modo via via
diverso all’aumentare della pressione (Fig. 4).
In particolare al di sotto di una
determinata temperatura essi possono subire un cambiamento
di fase (gas - liquido, gas - solido , liquido - solido.
Il fisico olandese Wan der Waals propose
la seguente celebre equazione per una mole di gas:
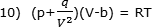
| Dove i termini |
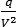 |
e b tengono conto risp.
dell’attrazione intramolecolare e del volume proprio
delle molecole. |
|