|
Parte seconda
Stabilità instabilità atmosferica
1 . L’equazione dei gas perfetti
|

Fig. 1 - J. Dalton. Eaglesfield 1766 -
Manchester 1844 (UK).
Chimico, fisico ed appassionato di meteorologia.
Autore anche di una prima teoria sulla composizione
atomica della materia
|
|
Abbiamo visto come sia stata dedotta
grazie alle intuizioni ed esperimenti di numerosi scienziati
quali Boyle, Gay Lussac, Avogadro e Clayperon la legge dei
gas perfetti:
1)
PV = nRT
Dove:
P = pressione,
V = volume, T=
temperatura assoluta n
= moli di gas perfetto,
R costante
universale che nel sistema MKS per una mole ha il valore di:
R =
8,31 J /K (joule per Kelvin)
Un’altra importante determinazione
relative ai miscugli di gas è dovuta a John Dalton che
stabilisce che la pressione di un tale miscuglio è la somma
della pressione parziale dei gas componenti .
2)
Pt = Σ Pi
In particolare si ha anche che la
pressione Pi del componente
imo
è data da
3)
Pi =ni/nt Pt
dove
ni/nt è la
frazione molare del componente
i
La relazione 1) relativa ad una mole di
gas coinvolge tre parametri fisici: pressione:
P, volume :V,
temperatura assoluta :T
, per cui lo stato fisico di un gas è determinato da 2
parametri fisici il terzo essendo deducibile dalla 1).
2. Il calore e il lavoro
|
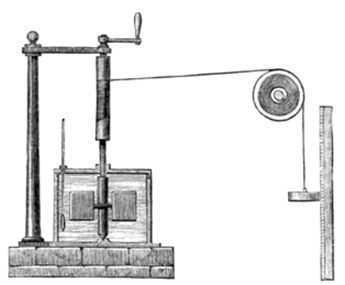
Fig.2 - Calorimetro con cui J. P. Joule misurò
l’equivalenza meccanica della caloria
(fonte: Wikypedia)
|
|
E’ esperienza comune che per riscaldare
un corpo è sufficiente metterlo a contatto od in prossimità
di un altro corpo a temperatura maggiore oppure produrvi
sopra un lavoro (sfregandolo, percuotendolo o comprimendolo
se si tratta di un gas). Sembrerebbe da ciò che esista una
relazione tra lavoro e calore trasmesso. Sino a metà
ottocento si parlava di “fluido calorico” (concetto
introdotto da Lavoisier a fine settecento) capace di
permeare ogni corpo che si trasmetteva tra uno più caldo ad
uno più freddo ma restava poco spiegabile la trasformazione
del lavoro in calore.
L’ipotesi atomistica della materia che
si stava affermando ha portato ad un’interpretazione
corretta: i corpi sono costituiti di particelle in costante
e disordinato movimento (energia cinetica) e dotate pure di
energia di legame. L’energia meccanica dissipata (ad esempio
per attrito, compressione) è trasformata in un aumento di
queste energie e viceversa almeno in parte tale agitazione
interna può essere trasformata in lavoro . Fondamentale fu
l’esperimento di Joule con cui determinò l’equivalenza
energetica del calore.
Con un apparato molto semplice, ma
perfettamente realizzato, costituito sostanzialmente, Fig.2,
da un contenitore isolato con una definita quantità d’acqua
ed un termometro di precisione immerso, un mulinello
azionato da un peso (forza agente
F = Mg : massa
M per
accelerazione di gravità
g) collegato ad
una puleggia il cui spostamento
S determinava
il lavoro immesso nell’apparato
(L =F S) e
trasferito nell’acqua tramite l’attrito viscoso della
stessa, determinò l’equivalente meccanico della caloria
(calore necessario per innalzare la temperatura di 1 grammo
d’acqua da 14,5 a 15,5°C)
1
cal =4,41 joule
Misura eccezionalmente precisa per la
strumentazione adottata (valore corretto = 4,186 joule)
3. La formulazione del primo principio
della termodinamica
|
La massa d’acqua dell’esperimento di
Joule s’era riscaldata ad una determinata temperatura
T perché le era
stato fornito del lavoro ad opera della forza di gravità, ma
il suo nuovo stato (determinato in questo caso solo dalla
temperatura) poteva essere raggiunto anche cedendo in parte
o solamente del calore. Tale costatazione ed ulteriori
esperimenti e riflessioni (in particolare da H. Helmotz, J.
R. Mayer e soprattutto R. Clausius) hanno portato a questa
formulazione:
ad ogni sistema materiale è associabile
una grandezza misurabile in joule definita “energia
interna”, U,
dipendente solo dalle variabili di stato (per i gas:
pressione P,
volume V,
temperatura T)
del sistema, la cui variazione è data da:
3)
ΔU = ΔQ – ΔW
Con
ΔQ = calore trasmesso al sistema,
ΔW= lavoro
prodotto dal sistema
In termini matematici più corretti
introducendo i differenziali
d
(differenziale esatto) e le forme differenziali
δ:
3’)
dU = δQ - δW
Dalla 3’) deduciamo come pur non essendo
il lavoro W
esercitato sull’ambiente ed il calore ricevuto
Q variabili di
stato lo è la loro differenza. |
|

Fig. 3 - James Prescott Joules , Sanford 1818 -
Sale 1889 (UK)
Fisico. A lui si deve in parte anche la formulazione
della prima legge della termodinamica e la scoperta
dell’effetto Joule (calore prodotto da una corrente
elettrica i in un conduttore di
resistenza R: Q = Ri2)
|
|
|
4 . L’impossibilità del moto perpetuo di
prima specie
Il primo principio della termodinamica
espresso dalla 3’) indica che se non c’è apporto di calore
il lavoro prodotto all’esterno da un sistema qualsiasi
comporta una di diminuzione della sua energia interna
U ed essendo
questa finita, finita sarà anche la durata del moto che
comporta sempre uno spreco energetico per attrito, viscosità
ecc. Il primo principio è un principio di conservazione:
L’aumento di energia di un sistema
corrisponde ad una uguale diminuzione di energia del
restante universo. In valori relativi si ha:
5)
ΔUsist + ΔUuniv = 0
Tale relazione vale per le reazioni
nucleari dove si tenga conto che perdita di massa è
produzione di energia attraverso la relazione di A. Einstein
E = Mc2
( E =
energia , c =
velocita della luce) ed ad
M si
sostituisca U+M.
|